En Estudio:
El proceso se basa en la violenta reacción del agua con algunos metales como el sodio, potasio o boro (menos volátil que los otros dos y por lo tanto más seguro) en una reacción exotérmica que produce como productos óxido de boro e hidrógeno, sin requerir un reactor especial:
2B(s) + 3H2O <====> B2O3(s) + 3H2 -433 kJ
La generación de hidrógeno además podría ser regulada controlando el flujo de agua hacia una serie de tanques que contendrían el boro y la energía que se desprende se utilizaría para la generación del vapor, siendo necesaria únicamente un sistema tipo batería que inicie la reacción El hidrógeno producido alimentaría posteriormente a un motor de combustión o una celda de combustible que haría funcionar el vehículo obteniéndose como subproducto únicamente óxido de boro y en la combustión del hidrógeno se recuperaría el agua inicial que podría ser alimentada de nuevo al tanque del vehículo, convirtiendo por lo tanto el vehículo en cuestión en un verdadero sistema de transporte de “emisiones cero”
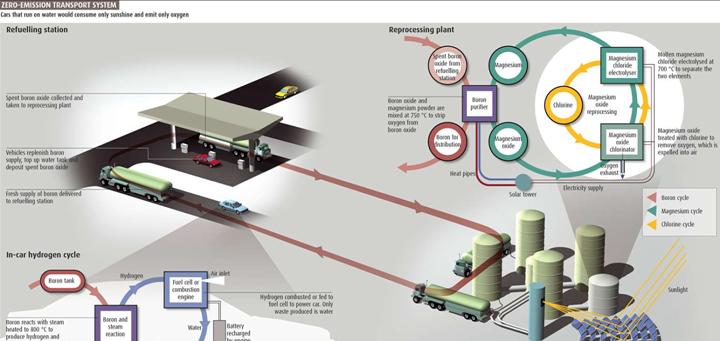
Sistema de transporte “cero emisión”. Los coches funcionan solo con agua y energía solar, emitiendo oxígeno como subproducto
2. La reacción de agua con boro para producir hidrógeno gas es muy rápida por lo tanto el vehículo dispone de la potencia necesaria para funcionar sin problemas
3. El óxido de boro generado en la reacción se puede reutilizar de nuevo, esta recuperación se puede hacer con energía solar o cualquier otra fuente renovable (calorica:
4. La producción de hidrógeno según se necesita evita la utilización de un sistema de almacenamiento de hidrógeno.
5. El agua que se produce en la combustión del hidrógeno puede ser reciclada y utilizada de nuevo como fuente de energía.
Abu – Hamed afirmó que la generación de hidrógeno que el motor que su equipo diseñara, seria regulado por una serie de tanques que contendrán boro en polvo. La reacción comenzara al suplírsele agua en vapor al tanque, por el momento el auto aún requerirá el uso de una batería para encenderlo. Ya que el motor se encuentre en marcha, le calor generado por la oxidación entre el boro y el agua se utilizará para calentar el agua entrante. Eventualmente, pequeñas cantidades de hidrógeno se podrán desviar del motor y almacenadas para utilizarse como energía para el encendido. El agua producida cuando el hidrógeno es quemado en la combustión interna del motor podrá ser capturada y enviada de regreso al tanque del vehículo, convirtiendo el proceso en uno sin ningún tipo de emisiones.
Hidrógeno en demanda no necesitará la instalación de líneas de distribución y creación de infraestructura para almacenarlo, además que hará más seguros a los vehículos que lo utilicen como energía.
Historia:
El revolucionario invento de un extremeño cobra actualidad 30 años después
A estas alturas Arturo Estévez Varela, no vive para leer la información de la revista NewScientist según la cual investigadores israelíes y norteamericanos llevan a cabo un proyecto conjunto para hacer realidad el revolucionario invento que el inventor extremeño ideó hace ya más de tres décadas. El 'motor de agua', que entonces parecía imposible que pudiera funcionar y fue acogido con desdén y escepticismo, no parece ahora una utopía y ya empieza a verse factible.
Pese a las numerosas pruebas que realizó por toda España ante auditorios repletos de personas Estévez no logró vencer los recelos de los científicos y técnicos. Pocos de los entendidos en la materia admitían que un motor que utilizaba agua, a la que se añadía un producto nunca revelado, pudiera servir de combustible y ser capaz de producir la energía suficiente para poner en movimiento un vehículo.
Pero lo cierto es que el motor se ponía en marcha en cuantas exhibiciones realizó para demostrar la viabilidad del invento. Su creador, nacido en Valle de
Entre las muchas teorías que, en su momento, circularon sobre el tema una de ellas era que la patente del motor de agua le fue comprada al inventor y arrinconada ante la amenaza que suponía para un sistema basado en el 'oro negro' que mueve dinero a raudales.
¿Verdad o mentira? No se sabe. Pero sí es cierto que en
Tras un período de gran actividad con presentaciones por toda España y frecuente aparición en los periódicos, Arturo Estévez desapareció de la escena pública y nada ha vuelto a saberse de él porque nadie ha vuelto a ocuparse del tema que durante mucho tiempo estuvo en candelero.
Su lista de patentes comenzó en 1931 y se alargaría hasta casi el centenar en el transcurso de los años. En los certámenes internacionales que se organizan para dar a conocer los inventos Arturo Estevez llegó a conseguir dos medallas de plata. Una por un 'purificador de gases contaminantes' y otra por su 'Sistema para recuperación de helicópteros en caso de avería' por el que, al parecer, se interesó a
Pero
Aditivo secreto
Su creador, sin embargo, demostraría una y otra vez la efectividad de su artilugio. En realidad, como insistía en precisar, no se trataba de un motor de agua, sino de un generador de hidrógeno a partir del agua que se suministraba junto con un reactivo cuya composición Estevez nunca reveló.
Según afirmaba, con dos litros y medio de agua y un kilo de su «producto secreto»(boro) se conseguían tres metros cúbicos de hidrógeno. «Es decir, tantas calorías como las que producen nueve litros de gasolina de 96 octanos.
Con ese combustible el inventor circuló con una motocicleta, a la que se le había sustituido el depósito de gasolina por el generador, en la prueba que durante dos horas se realizó en la plaza de España de Sevilla. Numerosas personas fueron testigos de que «aquello tiraba».
Boro:
Elemento químico de número y peso atómicos 5 y 10,81 uma, respectivamente, sólido, no metal, poco reactivo y de color rojo o negro, que no se encuentra aislado en la naturaleza y se clasifica en el grupo de los metales térreos.
Elemento químico perteneciente al grupo 13 del sistema periódico, grupo de los metales térreos. Su símbolo químico es B; su número y peso atómicos son 5 y 10,81 uma, respectivamente. Situado entre los metales y no metales; es un semiconductor con propiedades químicas más semejantes al carbono o al silicio que a los restantes elementos de su grupo.
Es el único elemento de su grupo que es un no metal.
La única propiedad metálica que conserva es el brillo que presentan sus cristales, de color rojo o
negro. Su primer potencial de ionización es elevado y los dos siguientes mucho mayores, es decir, el boro es poco reactivo y no tiene tendencia a ceder electrones. Presenta un punto de fusión de
Posición en la tabla periódica: grupo 13 (primero de los térreos).
Clasificación: térreos.
Número atómico: 5.
Peso atómico: 10,81 uma.
Capas de electrones:2. Configuración:1s1,2s2,2p1.
Electrones de valencia: 2s2,2p1.
Valencia: +3.
Estructura cristalina: romboédrica.
Estado en condiciones estándar de presión (760 mmHg)
y temperatura (298,15 ºK): sólido.
Aspecto: negro o rojo lustroso en estado cristalino
puro, polvo de color marrón en estado amorfo.
Radio atómico: 1,17 Å.
Radio iónico: 0,23 Å.
Radio covalente: 0,82 Å.
Volumen atómico: 4,6 cm3/mol.
Densidad a 300,15 ºK y 1 atm: 2,34 g/cm3.
Punto de fusión:
Punto de ebullición:
Entalpía de fusión: 22,18 kJ/mol.
Entalpía de vaporización: 480 kJ/mol.
Electronegatividad: 2,04 Pauling.
Dureza en la escala de Mohs: 9,3.
Primer potencial de ionización: 8,298 eV
Conductividad eléctrica: 1,0.10-12 106/(cm.W).
Conductividad térmica: 0,274 W/(cm.K).
Los compuestos que contienen boro se conocen desde la antigüedad, es el caso del bórax (Na2B4O7·10H2O), sustancia a partir de la cual Homberg obtuvo el ácido bórico (B(OH)3) en 1702.
No fue posible aislar el boro como elemento hasta 1808, año en el que lo hicieron, de manera independiente, Louis Thenard y Joseph Gay-Lussac, en Francia, y Sir Humphrey Davy, en Gran Bretaña. Para ello calentaron el óxido de boro (B2O3) y lo hicieron reaccionar con potasio metálico. De esta manera obtuvieron un polvo negruzco, amorfo, de escasa pureza que fue la única forma de boro conocida hasta que, en 1909, Weintraub aisló boro puro con estructura cristalina calentando una mezcla de hidrógeno y cloruro de boro en un arco voltaico de alto potencial.
Isótopos
Existen dos isótopos estables del boro, el 10B y el 11B, de los cuales el más abundante es el de número másico once. Ambos presentan espín nuclear (rotación del núcleo atómico), lo que hace que se empleen en espectroscopía de resonancia magnética nuclear.
Ha sido posible obtener otros isótopos de manera sintética, pero sus tiempos de vida media son muy cortos y decaen rápidamente hacia nucleidos más estables.
Propiedades
El boro se enlaza a los restantes elementos covalentemente. Numerosos compuestos del boro tienen deficiencia de electrones, ya que el octeto habitual de electrones no está constituido en torno al átomo de boro. Esto hace que el átomo de boro tenga tendencia a captar electrones y que los compuestos se comporten como ácidos de Lewis.
Las estructuras cristalinas consisten en complicadas redes tridimensionales de icosaedros que contienen oquedades lo suficientemente grandes como para albergar átomos externos. Las disoluciones de estas estructuras muestran propiedades que difieren cuantitativamente, e incluso cualitativamente, de la sustancia pura. Las propiedades mecánicas se ven modificadas considerablemente y la ocupación de los intersticios por diferentes átomos hace que varíen las propiedades electrónicas (conductividad).
Presenta una baja reactividad a temperatura ambiente, no se ve afectado por el agua, el aire, ni los ácidos y bases diluidos. Sin embargo, al rojo reacciona rápidamente con el nitrógeno para dar el nitruro de boro (BN) y con el oxígeno para formar el óxido de boro (B2O3). Es el único elemento de su grupo que reacciona con el hidrógeno para dar una serie de compuestos que reciben el nombre genérico de boranos, todos ellos tóxicos y de olor muy desagradable; también forma haluros de fórmula general BnXn. El interés de los haluros es que contienen celdas cerradas de átomos de boro. Son especialmente importantes los cloruros de boro (B4Cl4, B8Cl8 y B9Cl9); estos compuestos son vivamente coloreados, en contraste con los derivados típicos del boro, pero su preparación y manipulación son excesivamente complicadas.
Es capaz de reducir a todos los óxidos metaloides y a la mayoría de óxidos metálicos.
En sus compuestos el boro actúa como un no metal, no obstante en estado puro es un semiconductor. Tiene un gap de energía entre 1,50 y 1,56 eV, superior al del silicio o al del germanio, lo que hace que sus propiedades conductoras aumenten con la temperatura.
La forma alotrópica b-romboédrica muestra una apariencia y unas propiedades ópticas semejantes a las del diamante con un dureza sólo ligeramente inferior.
En los ensayos a la llama los compuestos de boro presentan una coloración verde característica.
Fuentes
El boro es un elemento presente en la naturaleza, aunque no en estado libre, se puede encontrar en forma de boratos alcalinotérreos en los océanos, en las rocas sedimentarias, el carbón, el esquisto y en algunos suelos o como ácido bórico. Ampliamente distribuido en la naturaleza, es posible encontrarlo en concentraciones de alrededor de 10 mg/kg en la corteza terrestre y alrededor de 4,5 mg/l en los océanos. Esto hace que ocupe el 38º lugar en abundancia en la corteza terrestre.
Las primeras fuentes de obtención de este elemento fueron el bórax (Na2B4O7.10H2O), abundante en el desierto de Mohave de California, y el ácido bórico (H3BO3) presente en las solfataras (emanaciones volcánicas) de
Obtención
La obtención de boro elemental en estado puro es terriblemente compleja, debido a su elevado punto de fusión y a lo corrosivo de la disolución. Sólo es posible su preparación en grandes cantidades renunciando a la pureza, que como máximo será de un 95-98%. El boro en estado amorfo puede obtenerse a escala comercial a partir de su óxido (B2O3) por reducción con magnesio metálico, posteriormente se lava energéticamente con un álcali, con ácido clorhídrico y por último con ácido fluorhídrico. El óxido de boro se obtiene por fusión del ácido bórico (B(OH)3), el cual a su vez proviene del bórax (Na2B4O7·10H2O).
Reducción de B2O3 con Mg: B2O3 + 3Mg ® 2B + 3MgO
El problema aparece a la hora de querer conseguir boro puro cristalizado, aunque se deseen cantidades muy pequeñas con fines de investigación. Cabe la posibilidad de obtener varias formas alotrópicas.



1 comentario:
Proyecto central solar
Publicar un comentario